只需要点击下方QQ发送“高考化学核心考点”,就可以免费领取《高考化学核心考点》了!
对于一般的可逆反应:mA(g)+nB(g)⇌ C(g)+qD(g),当在一定温度下达到化学平衡时,其化学平衡常数可以表示为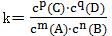 。
。
(1)利用化学平衡常数可判断化学平衡所处的温度数值。K只受温度影响,与反应物或生成物的浓度变化无关。根据平衡状态中各组分的物质的量浓度,可以计算出该温度下的化学平衡常数,进而判断反应温度。
(2)利用化学平衡常数可判断可逆反应的进行方向和能量变化。化学平衡常数增大,说明可逆反应向正反应方向移动,结合反应温度的变化,可以判断反应的能量变化。
(3)利用化学平衡常数可判断可逆反应是否处于平衡状态。假设某温度下可逆反应mA(g)+nB(g)⇌pC(g)+qD(g)的平衡常数为K,某时刻反应物和生成物的浓度关系如下: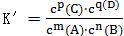 ,若K′=K,v(正)=v(逆),可逆反应处于化学平衡状态;若K′﹤K,v(正)﹤v(逆),可逆反应向正反应方向进行;若K′﹥K,v(正)﹤v(逆),可逆反应向逆反应方向进行。
,若K′=K,v(正)=v(逆),可逆反应处于化学平衡状态;若K′﹤K,v(正)﹤v(逆),可逆反应向正反应方向进行;若K′﹥K,v(正)﹤v(逆),可逆反应向逆反应方向进行。
(4)利用化学平衡常数可以进行相关计算。根据平衡建立过程中组分的物质的量浓度变化,结合化学平衡带数,可以进行各组分的物质的量(或浓度)和转化率等相关计算。
注意:影响化学反应速率的因素,不一定影响化学平衡(如催化剂);影响化学平衡的因素,不一定影响化学平衡常数(如浓度、压强),只有温度对二者都有影响。
