只需要点击下方QQ发送“高考化学解题模型”,就可以免费领取《高考化学解题模型》了!
盐溶液中的离子跟水电离出的H+ (或OH-)结合生成弱电解质,破坏了水的电离平衡,改变了溶液中H+和OH-的相对浓度,使溶液呈碱性(或酸性)。
盐类水解的规律:谁弱谁水解,谁强显谁性;两强不水解,两弱更水解;越弱越水解;越稀越水解;越热越水解。
1.强碱弱酸盐水解(如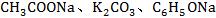 等)的实质是弱酸根离子水解,消耗了水中的H+,使OH-过剩,溶液呈碱性。
等)的实质是弱酸根离子水解,消耗了水中的H+,使OH-过剩,溶液呈碱性。
(1)由多元弱酸根离子形成的盐,其水解是分步的,且第一步水解是主要的,第二步水解很微弱。溶液的酸碱性主要取决于第一步水解的程度。
(2)多元弱酸的酸式根离子同时具备电离和水解两种倾向,有的以水解为主,溶液呈碱性(如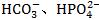 等);有的则以电离为主,溶液呈酸性(如
等);有的则以电离为主,溶液呈酸性(如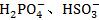 等)。
等)。
2.强酸弱碱盐水解[如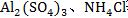 等]的实质是弱碱阳离子水解,消耗了水中的OH-,使溶液中的H+过剩,溶液呈酸性。
等]的实质是弱碱阳离子水解,消耗了水中的OH-,使溶液中的H+过剩,溶液呈酸性。
注意:多元弱碱盐虽然也分步水解,但因多元弱碱的阳离子水解情况比较复杂,故通常看成是一步进行的:如Al3+的水解,一般写成: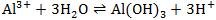 。
。
3.弱酸弱碱盐(如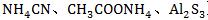 )中阴离子结合水中的H+,阳离子结合水中的OH-,相互促进水解,所以水解程度较大。溶液的酸碱性由生成的弱酸和弱碱的相对强弱决定,若弱碱较强则呈碱性;若弱酸较强则呈酸性;若强弱相当,则接近中性。
)中阴离子结合水中的H+,阳离子结合水中的OH-,相互促进水解,所以水解程度较大。溶液的酸碱性由生成的弱酸和弱碱的相对强弱决定,若弱碱较强则呈碱性;若弱酸较强则呈酸性;若强弱相当,则接近中性。
在弱酸弱碱盐中,有些盐(如Al2S3等)由于阳离子、阴离子都易水解,且水解产物中有气体或难溶物质或易分解物质时盐的水解往往能进行到底,这样的离子方程式应用“═”连接,并且生成物中要标出气体符号“↑”或沉淀符号“↓”,如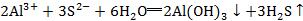 。
。
