1.沉淀溶解平衡的形成
绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为0。以难溶物AgCl为例,在一定温度下,当沉淀溶解和生成的速率相等时,便得到AgCl的饱和溶液,即建立下列动态平衡:
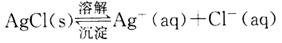
2.溶度积常数
(1)表达式
以Fe(OH)3沉淀溶解平衡为例:
Fe(OH)3(s)⇌Fe3+(aq)+3OH-(aq) Ksp=c(Fe3+)•c3(OH-)
(2)意义
难溶电解质Ksp的大小反映了难溶电解质在水中的溶解能力,对于化学式组成中阴、阳离子个数比相同的物质,Ksp越小,难溶电解质在水中的溶解能力越弱。
(3)影响因素
溶度积常数(Ksp)与其他化学平衡常数一样,只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中的离子浓度无关。